第三周期元素性质的递变
钠、镁与水的反应
钠与水反应
实验操作
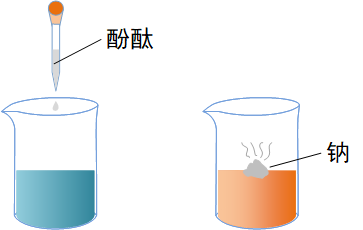
实验现象
钠熔成小球,浮于水面,四处游动,发出“嘶嘶”的响声。生成溶液滴加酚酞后变红。
镁与水反应
实验操作
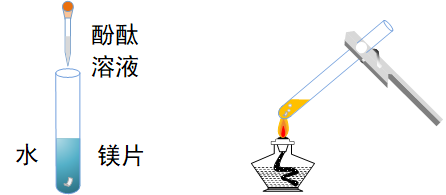
实验现象
冷水中,镁条只有少量无色气泡。加热后,无色气泡冒出速度加快。滴加了酚酞的产物溶液变红。
镁条使用前应用砂纸除去表面的氧化膜。
对比结论
的金属性强于 。
钠、镁、铝的最高价氧化物对应水化物的碱性
碱性强弱
是强碱, 是中强碱。 是两性氢氧化物。 结论
金属性:
两性氢氧化物
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,叫两性氢氧化物。
弱酸如碳酸,弱碱如氨水无法溶解
。
溶液中逐滴加入 , 先产生白色沉淀 ,然后白色沉淀溶解。
最高价氧化物对应水化物(含氧酸)的酸性强弱:
同周期
结论:
同周期主族元素性质递变规律
由于第三周期元素核外均为3个电子层,但从左至右核电荷数逐渐增多,核对核外电子的吸引越强,既金属性逐渐减弱,非金属性逐渐增强。
