乙醇的氧化反应
乙醇的燃烧
乙醇易燃烧,燃烧时火焰呈淡蓝色,化学方程式为:
乙醇燃烧放出大量的热,燃烧产物无污染。若为不完全燃烧,还会生成一氧化碳,有黄色火焰。
乙醇具有再生性,是一种的绿色能源。
乙醇的催化氧化
实验步骤
- 向试管里注入约
无水乙醇,取一根光洁的铜丝,下端绕成螺旋状(增大铜丝的作用面积),在酒精灯上灼烧至红热。 - 趁热将铜丝插入无水乙醇中,反复几次,注意观察反应现象,小心地闻试管中液体产生的气味。
- 向试管里注入约
实验现象
- 红色光亮的铜丝灼烧后变为黑色。
- 趁热插入无水乙醇中后,铜丝表面颜色又变成红色。在每次实验中,铜丝表面的颜色变化都是”红色-黑色-红色“,原有的乙醇气味消失,闻到特殊的刺激性气味。
反应原理:
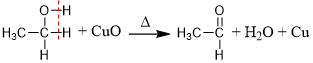 (铜丝由黑变红)。
(铜丝由黑变红)。反应实质(去H氧化)
乙醇脱去与羟基相连的碳原子上的一个氢原子和羟基上的氢原子,这两个氢原子与氧原子结合生成
。若醇分子中与羟基相连的碳原子上无氢原子,则不能被催化氧化。 总化学方程式:
(乙醇的官能团为醛基:
实验结论:
- 乙醇在加热和有催化剂(如
或 )存在等条件下,被空气中的氧气氧化成乙醛。反应的化学方程式为 。
- 乙醇在加热和有催化剂(如
乙醇与强氧化剂反应
反应原理:
乙醇能被酸性高锰酸溶液氧化成乙酸,使其紫色褪去;也能被酸性重铬酸钾(
)溶液或( )氧化成乙酸, (或 )被还原为 。化学方程式为:
(该反应常用来检测司机是否酒后驾驶车辆)